Comment les Adjuvants d’Aluminium des vaccins provoquent l’Autisme ?
Résumé :
L’autisme est un trouble neuro-développemental causé par une activation immunitaire (inflammation) cérébrale précoce, et la production de certaines cytokines (IL-6, IL-17) pendant les années de formation du cerveau du nourrisson (in utero ou après la naissance).
Cette activation immunitaire va provoquer un dysfonctionnement dans le développement cérébrale, par le biais de la surproduction des cytokines pro-inflammatoires, nécessaires à petites doses, mais délétères à fortes doses (perturbation au niveau de la formation des synapses, notamment).
L’aluminium est un neurotoxique capable de provoquer la production d’IL-6 dans le cerveau : la plausibilité biologique selon laquelle les Adjuvants d’Aluminium peuvent provoquer l’autisme est démontrée par plusieurs études expérimentales sur l’animal.
Aucune étude n’est aujourd’hui en mesure de démontrer l’innocuité des doses d’Aluminium injectées en respect du calendrier vaccinal (américain et français).
Toutes les références sont compilées à la fin de l’article.
Les Centers for Disease Control états-uniens (CDC), l’une des plus hautes autorités sanitaires du monde, affirment que les vaccins et leurs composants ne sont pas considérés comme une cause potentielle de l’autisme. Ces affirmations des CDC sont génériques et englobent sans distinction tous les vaccins et leurs ingrédients. Par exemple, les CDC déclarent : « les vaccins ne causent pas l’Autisme ». « Il n’existe aucun lien entre autisme et vaccins ». « Aucun lien n’a été établi entre n’importe quel ingrédient des vaccins et les Troubles du Spectre Autistique. »
https://www.cdc.gov/vaccinesafety/concerns/autism.html
Ces affirmations ne reposent sur aucune donnée scientifique.
D’abord, les CDC se réfèrent au rapport de l’Institut de Médecine Américain (IOM),
https://www.nap.edu/read/13164/chapter/12#546
datant de 2011 pour affirmer qu’il n’existe aucun lien entre vaccination et autisme. Or le rapport, qui passe en revue 8 vaccins, dit notamment p. 546, par rapport au DTP (c’est-à-dire un Diphtérie-Tétanos-Coqueluche) contenant de l’aluminium,
« Conclusion 10.6 : les preuves sont inadéquates pour accepter ou conclure à une relation causale entre le vaccin DTP et l’autisme ».
(En clair, les études de sécurité n’ont pas été réalisées. NdT)
Les autres preuves qu’avancent les CDC se limitent à des études sur le ROR (Taylor 2014), le conservateur Thimerosal (Taylor 2014) et le nombre d’antigènes (DeStefano 2013). Le Dr Franck DeStefano du bureau de la sécurité de la vaccination est le co-auteur d’une étude (Glanz 2015) qui affirme :
« A ce jour, il n’y a pas eu d’étude portant sur la population, spécifiquement conçue pour évaluer l’association entre des résultats cliniques significatifs et des ingrédients autres que les antigènes et le Thimerosal. »
Cette déclaration s’applique, entre autres, aux adjuvants d’Aluminium des vaccins. Les études sur le ROR ne peuvent pas servir de preuve pour la sécurité des autres vaccins (ce qui est pourtant systématiquement le cas), d’autant plus que les autres vaccins contiennent des adjuvants d’Aluminium alors que le ROR n’en contient pas. Ces affirmations beaucoup trop globales et génériques soutenant qu’« aucun vaccin ni aucun ingrédient ne peut causer l’autisme » ne reposent sur aucune preuve scientifique.
Au contraire, les déclarations des CDC sont contredites par un large et solide corpus d’études scientifiques, de plus en plus nombreuses, preuves qui incluent :
- Des études démontrant les effets neurotoxiques et neuro-inflammatoires (c’est-à-dire provoquant l’activation de la microglie du cerveau) à des doses d’adjuvants d’aluminium plus faibles ou équivalentes aux doses injectées aux nourrissons selon le calendrier vaccinal des CDC (Crépeaux 2017, Petrik 2007, Shaw 2013, Shaw 2009)
- Des études démontrant le lien entre vaccins et les lésions cérébrales dues à une activation immunitaire (Zerbo 2016, Li 2015)
- Des études démontrant qu’une activation immunitaire précoce, pendant les premières années de vie, est un facteur de causalité pour l’autisme et d’autres troubles neuro-développementaux (dont la schizophrénie) (Meyer 2009, Deverman 2009, Estes 2016, Kneusel 2014, Careaga 2017, Meyer 2014). Les preuves s’accumulent pour démontrer que l’activation immunitaire induite par la vaccination, et par les adjuvants d’aluminium en particulier, peut causer des troubles mentaux et neuro-développementaux, dont l’autisme.
Cet article présente les preuves scientifiques que les adjuvants d’aluminium peuvent causer l’autisme et d’autres lésions cérébrales. Il explique également pourquoi les études qui démontrent prétendument la sécurité des adjuvants d’aluminium n’observent pas d’effets neurologiques indésirables.
 Fig 1: Mécanisme par lequel les adjuvants d’aluminium peuvent causer l’autisme. Chaque étape est démontrée par plusieurs études scientifiques
Fig 1: Mécanisme par lequel les adjuvants d’aluminium peuvent causer l’autisme. Chaque étape est démontrée par plusieurs études scientifiques
L’Activation Immunitaire : une cause de l’autisme et des maladies mentales
Le terme « Activation Immunitaire » décrit la réaction des cellules composant le système immunitaire. Le cerveau en développement peut être endommagé par une activation immunitaire, impliquant des effets à long terme (Meyer 2009, Deverman 2009, Estes 2016, Kneusel 2014, Careaga 2017, Meyer 2014). Les lésions provoquées par une activation immunitaire sont observées dans les cas d’autisme, de schizophrénie, de dépression ainsi que d’autres maladies mentales ou troubles neuro-développementaux.
L’activation immunitaire agit sur le cerveau par le biais de molécules de signalisation synthétisées par les cellules du système immunitaire, spécifiquement les cytokines (Estes 2016, Meyer 2014, Smith 2007, Choi 2016, Pineda 2013).
(Remarque : les cytokines peuvent augmenter ou inhiber la réaction immunitaire, elles sont dites « pro-inflammatoires » ou « anti-inflammatoires ».)
Il est déjà reconnu que l’activation immunitaire due à une infection, pendant la grossesse, est un facteur de risque pour le déclenchement de l’autisme et de la schizophrénie chez le fœtus (Ciaranello 1995, Atladottir 2010, Brown 2012). L’intensité et la durée de l’activation immunitaire ainsi que la sécrétion des cytokines semblent être des facteurs importants pour le risque de développer l’autisme (Meyer 2014).
En effet :
- Une activation immunitaire intense est associée à un plus grand risque d’autisme (Careaga 2017, Atladottir 2010).
- Une inflammation chronique est également associée à un plus grand risque d’autisme (Jones 2016, Zerbo 2014)
Cependant, il n’y a aucune preuve qu’une activation immunitaire de courte durée et de faible intensité, provoquée par une maladie infantile classique, puisse provoquer des troubles autistiques.
En effet :
- Le Timing (fenêtre d’exposition) de l’activation immunitaire, par rapport aux différentes phases de développement du cerveau, est également un important facteur (Meyer 2006, Meyer 2009). Tout comme pour les perturbateurs endocriniens : la période d’exposition est un facteur majeur de troubles.
Les expérimentations animales ont porté sur les effets de l’activation immunitaire sur le développement des nourrissons, durant la grossesse et la période postnatale (Meyer 2009, Deverman 2009, Estes 2016, Kneusel 2014, Careaga 2017, Meyer 2014). Dans ces expériences, des animaux en gestation (souris, rats et singes) ou des nouveaux-nés ont reçu des injections de produits non infectieux, capables de stimuler le système immunitaire, comme des « poly-IC » (capables de mimer une infection virale) ou des lipopolysaccharides (LPS, qui miment une infection bactérienne).
Ces substances activent le système immunitaire sans causer d’infection, ici chez la femelle enceinte, et chez les nouveaux-nés. Elles provoquent de la fièvre ainsi que la production de cytokines et peuvent donc avoir des effets substantiels sur le développement du cerveau, si l’activation est suffisamment intense et prolongée et si l’exposition survient durant les étapes sensibles du développement.
Chez la souris, il a été démontré que l’activation immunitaire peut provoquer trois symptômes comportementaux typiques de l’autisme : une socialisation et une communication diminuées, ainsi qu’une augmentation des comportements répétitifs (Malkova 2012). Il est aussi démontré que l’activation immunitaire peut causer des neuropathologies (Weir 2015) et des anomalies comportementales chez les singes, analogues à celles des humains autistes ou schizophrènes (Bauman 2014, Machado 2015). Voir Figure 2.

Fig 2: (Bauman et al. 2014)
L’Activation Immunitaire Maternelle chez les singes cause des anomalies comportementales chez la jeune progéniture analogues aux comportements des autistes et des schizophrènes.
MIA1 (en noir) : l’activation immunitaire a eu lieu pendant le premier trimestre de gestation
MIA2 (en gris) : l’activation immunitaire a eu lieu pendant le deuxième trimestre de gestation
CON (en blanc) : groupe contrôle (injection d’une solution saline)
Traduction de la légende de la figure 2 :
La progéniture issue du groupe ayant expérimenté une Activation Immunitaire Maternelle (MIA) témoigne d’une augmentation de la fréquence des stéréotypies motrices et des comportements auto-dirigés (par exemple, mettre son doigt dans sa bouche). Graphique de gauche : quand ils sont observés seuls dans une grande cage à l’âge de 10 mois, quand l’activation maternelle a eu lieu pendant le second trimestre (MIA2), les animaux produisent significativement plus de mouvements répétitifs que les animaux de contrôle (CON). Ceux pour qui l’activation immunitaire maternelle a eu lieu pendant le premier trimestre (MIA1) produisent aussi plus de mouvements répétitifs que le groupe contrôle, mais cette différence n’est pas statistiquement significative (p=.06). Graphique du milieu : quand on les observe seuls à 22 mois, les MIA1 produisent significativement plus de mouvements répétitifs. Les MIA du second trimestre produisent aussi de façon significative plus de mouvements répétitifs que le groupe contrôle à 22 mois. Graphique de droite : Quand ils sont testés à 17 mois dans le labyrinthe-Y test de préférence sociale, les animaux issus du groupe MIA2 produisent significativement plus de mouvements répétitifs que les animaux de contrôle. (B) La progéniture du groupe Activation Immunitaire Maternelle montre une vocalisation affiliative plus faible. Graphique de gauche : à 22 mois, la progéniture MIA2 produit significativement moins de roucoulements (coo calls) que les animaux contrôles. (C) La progéniture issue du MIA montre des interactions inappropriées face à des individus étrangers de la même espèce. Graphique de gauche : les MIA du premier trimestre démontrent des interactions sociales inappropriées face à des congénères étrangers, classé par de plus haute fréquences d’approche et bougeant plus fréquemment à portée d’un animal étranger. Graphique de droite : la progéniture MIA du premier trimestre est restée près de l’animal étranger, classé par durée de contact physique ou à portée de l’animal étranger.
L’activation immunitaire peut aussi causer des effets non comportementaux, physiologiques que l’on associe avec l’autisme humain (entre parenthèses, les études qui font ce lien) :
1) réduction du nombre de cellules de Purkinje dans le cervelet (Shi 2009);
2) dysfunctionnement des mitochondries (les sources d’énergie des cellules) (Giulivi 2013);
3) Une augmentation du volume cérébral (causé par une exposition à IL-6, Wei 2012(b)) et de la densité des neurones dans le cerveau (Smith 2012);
4) Des inflammations chroniques cérébrales à long terme (Garay 2012);
5) Perturbation du microbiote (dysbiose intestinale) (Hsiao 2013).
Ces similitudes physiologiques non comportementales apportent une preuve supplémentaire que le modèle de l’activation immunitaire est pertinent pour l’autisme humain. Les effets physiologiques de l’activation immunitaire ont été examinés (Labouesse 2015). Les Interleukines 6 (IL-6) et 17a (IL-17) ont été identifiées comme induisant les effets comportementaux de l’activation immunitaire (Smith 2007, Malkova 2012, Choi 2016, Pineda 2013, Wei 2012(a), Wei 2013, Parker-Athill 2010, Wei 2016). Les découvertes sur l’IL-6 ont été répliquées par différents chercheurs, utilisant différentes méthodes expérimentales.
Par exemple, dans une expérience utilisant les poly-IC, un comportement anormal est presque complètement évité si on injecte simultanément des anticorps bloquant les IL-6 (Smith 2007, Pineda 2013). Une injection d’IL-6 toute seule cause un comportement anormal proche du comportement que l’on obtient après une activation immunitaire due aux poly-IC (Smith 2007). Le fait d’inhiber la sécrétion d’IL-6 dans un modèle d’autisme génétique (souris BTBR) a rendu le comportement social normal (Wei 2016). Ces résultats démontrent que IL-6 est responsable des comportements anormaux typiques de l’autisme.
Le laboratoire de Patterson (du fameux California Institute of Technology « Caltech ») a été le premier à signaler que IL-6 est responsable des effets comportementaux autistiques, par activation immunitaire (Smith 2007). Deux études études de ce groupe de recherche établissent que :
« IL-6 joue un rôle central dans le processus par lequel l’Activation Immunitaire Maternelle cause des altérations comportementales à long terme chez la progéniture … Bloquer IL-6 prévient >90% des changements observés dans la progéniture des femelles à qui on a injecté les poly-IC, montrant que l’expression des gènes change, tout comme les changements comportementaux sont rendus normaux par l’élimination de l’IL-6 de la réponse immunitaire maternelle. » (Smith 2007)
« IL-6 est nécessaire et suffisante pour produire ces effets puisque ces effets (…) sont évités si on injecte aux souris enceintes à la fois des poly-IC et des anticorps anti-IL-6, et sont au contraire obtenus par une simple injection d’IL-6 à la mère. » (Garay 2013)
L’exposition du cerveau à des doses élevées d’IL-6 par un virus artificiel (engineered) a montré que cette exposition à IL-6, après la naissance, cause des comportements autistiques (Wei 2012(a)). L’étude de Wei 2012(a) affirme :
“Nous avons démontré que IL-6 est un important facteur dans les comportements autistiques. Les souris dont le cerveau a un haut taux d’IL-6 ont développé des comportements autistiques, incluant une capacité cognitive altérée, des déficits d’apprentissage, un caractère et une accoutumance anxieux anormaux, ainsi qu’une diminution de l’interaction sociale, plus tardive. Ces découvertes suggèrent qu’une élévation d’IL-6 dans le cerveau pourrait moduler certaines altérations pathologiques et contribuer au développement de l’autisme. » (Wei 2012(a))
Une récente étude montre que IL-17 agit également avec IL-6 pour causer des anomalies comportementales autistiques, et un développement cortical atypique chez la souris (Choi 2016). Le fait de bloquer IL-6 ou IL-17 prévient le comportement autistique. Une injection d’IL-17 seule cause un comportement autistique (Choi 2016). IL-6 est connue pour induire IL-17 en favorisant le développement des cellules Th17 qui produisent IL-17. L’activation immunitaire dans les modèles animaux semble être un modèle valide pour les troubles neurologiques et psychiatriques chez l’humain (Estes 2016, Careaga 2017, Meyer 2014). L’étude d’Estes 2016 soutient la validité de ce modèle d’activation immunitaire pour l’humain :
« Ces modèles animaux d’Activations Immunitaires Maternelles (MIA) remplissent tous les critères de validité requis pour un modèle de maladie : ils imitent un facteur de risque connu lié à la maladie (validité conceptuelle), ils témoignent d’un large spectre de symptômes liés à la maladie (validité apparente), et ils peuvent être utilisés pour prédire l’efficacité des traitements (validité prédictive). » (Estes 2016)
L’étude suggère que IL-6 et IL-17 jouent un rôle dans l’autisme humain. Par exemple, IL-6 est retrouvé en quantité significativement élevée dans le cervelet des autistes humains (Wei 2011) et est très élevé dans certaines régions cérébrales d’individus autistes (Vargas 2005). Les autistes humains qui ont reçu en traitement l’anti-inflammatoire lutéoline flavonoïde ont vu leurs symptômes autistiques améliorés, si ces individus voient leur taux sanguins d’IL-6 baisser (Tsilioni 2015). Ce résultat est cohérent avec un rôle causal d’IL-6 pour l’autisme humain. De même, IL-17 est élevé chez les autistes (Akintunde 2015, Al-Ayadhi 2012, Suzuki 2011). La vitamine D réduit la production d’IL-17 (Bruce 2011, Wobke 2014, Drozdenko 2014) et améliore les comportements autistiques chez l’humain (Saad 2016, Jia 2015). Les découvertes sur la vitamine D sont cohérentes avec un rôle causal d’IL-17 pour l’autisme humain.
Le fonctionnement d’IL-6 semble être identique chez la souris et chez l’humain. Aucune différence entre l’humain et la souris, en ce qui concerne IL-6, n’est signalée dans la revue de Mestas 2004. Le fonctionnement d’IL-6 est préservé à travers les espèces (Brown 2014). Le développement du système nerveux central est régi par les mêmes principes chez les rongeurs et chez l’humain (Brown 2014). Ainsi, le fait que IL-6 cause des anomalies comportementales proches de l’autisme chez l’animal mérite une présomption de validité pour l’humain.
L’activation immunitaire est un facteur de risque pour l’autisme, la schizophrénie et d’autres troubles neurologiques et psychiatriques. Les cytokines IL-6 et IL-17 induisent les effets comportementaux autistiques de l’activation immunitaire dans les modèles animaux. Les preuves disponibles soutiennent un rôle causal pour IL-6 et IL-17 dans l’autisme humain.
Activation immunitaire Maternelle Vs Postnatale
Le timing de l’activation immunitaire est un facteur important pour le cerveau. Le cerveau en développement est sensible à l’activation immunitaire. Le cerveau adulte, mature, n’est apparemment pas aussi vulnérable. La sensibilité à l’activation immunitaire semble décliner avec la maturation du cerveau (Meyer 2014, Meyer 2007).
Dans la plupart des expériences, la progéniture est exposée à une activation immunitaire durant la gestation (en stimulant le système immunitaire de la mère). Au contraire, la plupart des vaccins sont administrés après la naissance. Cela pose la question de l’activation immunitaire postnatale : peut-elle avoir des effets similaires sur le cerveau à ceux observés lors d’une activation immunitaire maternelle ? Diverses études indiquent que le cerveau peut être affecté négativement par une activation immunitaire post-natale.
Les expériences portant sur l’activation immunitaire post-natale, ainsi que des rapports de cas humains, et la connaissance des phases de développement du cerveau, suggèrent que le cerveau humain est vulnérable à l’activation immunitaire pendant les années qui suivent la naissance.
Dans les expériences sur l’activation immunitaire maternelle, la signalisation inflammatoire et certaines cytokines (IL-6) traversent le placenta pour atteindre le fœtus. Par conséquent, l’activation immunitaire de la mère cause l’activation immunitaire et la production élevée de cytokines dans le fœtus, et son cerveau (Oskvig 2012, Ghiani 2011).
L’activation immunitaire post-natale peut avoir des effets neurologiques indésirables, dont une sensibilité accrue aux crises d’épilepsie (Chen 2013, Galic 2008), des déficits d’apprentissage et de mémoire (Harre 2008), et une augmentation de la formation des synapses excitatrices (Shen 2016). Les troubles épileptiques, dysfonctionnement dans l’apprentissage et de mémoire, ainsi qu’une signalisation excitatrice élevée sont associés à l’autisme.
Un taux élevé d’IL-6 dans le cerveau pendant la période post-natale cause un déséquilibre dans les circuits neuronaux et provoque des comportements autistiques chez la souris (Wei 2012(a)). Ce déséquilibre observé dans l’étude de Wei 2012 (a) consiste en un excès de synapses excitatrices et un déficit dans les synapses inhibitrices. Voir Fig.3. Une signalisation excitatrice excessive est observée chez les autistes humains (Robertson 2016, Freyberg 2015). En effet, le déséquilibre entre les signalisations excitatrices et inhibitrices (vis-à-vis d’une excitation importante) est considérée comme une caractéristique essentielle de l’autisme (Robertson 2016, Freyberg 2015).

Fig 3: L’augmentation d’IL-6 dans les cerveaux des souris (juste après la naissance) a provoqué une augmentation du nombre de synapses excitatrices (VGLUT1) et une baisse du nombre de synapses inhibitrices (VGAT). Une signalisation excitatrice excessive est observée chez les autistes humains. Rouge= augmentation d’IL-6; Noir=Contrôle. VGLUT1= synapses excitatrices ; VGAT= synapses inhibitrices. *P<0.05, **P<0.01 and ***P <0.001. Adapté de Wei et al 2012(a).
Dans les expériences d’Activation Immunitaire Maternelle sur les souris (Coiro 2015), des comportements liés à l’autisme et des anomalies de l’épine dendritique (liées à l’autisme et à la schizophrénie) ont été améliorés par l’administration d’anti-inflammatoires après la naissance. Le médicament était donné à la naissance et pendant 2 semaines, ce qui correspond grossièrement à l’âge de 2 ans pour l’humain (Semple 2013). Ce résultat indique que le développement cérébral peut être affecté par une inflammation post-natale, pendant la période qui correspond à celle pendant laquelle sont administrés les vaccins aux humains.
Plusieurs études de cas décrivent des enfants en bonne santé qui ont soudainement développé des comportements autistiques durant ou suite à une infection cérébrale. Tous ces cas montraient des signes d’inflammations cérébrales intenses. Voici une brève description de ces études :
- Delong 1981: description de 3 enfants, âgés de 5, 7 et 11 ans, avec des comportements autistiques sérieux associés à des inflammations cérébrales. Ces inflammations étaient soupçonnées dans 2 cas et confirmée dans le troisième. Les enfants de 5 et 7 ans se sont rétablis complètement, l’enfant de 11 ans s’est partiellement rétabli.
- Marques 2014: description d’une fillette de 32 mois d’abord en bonne santé, qui souffrit d’une régression autistique à la suite d’une infection virale du système nerveux central, associée à une inflammation cérébrale.
- Ghaziuddin 2002 : description d’un garçon de 11 ans d’abord en bonne santé, qui souffrit d’une régression autistique permanente après une infection cérébrale par le virus herpès, associée à une inflammation du cerveau.
- Gillberg 1986 : description d’une jeune fille de 14 ans, d’abord en bonne santé, qui fit une régression autistique permanente après une infection cérébrale par le virus herpès, associée à une inflammation du cerveau.
L’explication la plus simple concernant ces cas est de conclure que le comportement autistique a été causé par une inflammation intense et une production de cytokines dans le cerveau. En conséquence, ces cas indiquent que le cerveau humain reste vulnérable à l’activation immunitaire bien après la naissance, bien que cette vulnérabilité diminue presque certainement avec la maturation du cerveau. La susceptibilité à l’autisme induit par une inflammation, chez les enfants plus âgés, suggère fortement que les enfants plus jeunes, de 0-2 ans, sont également vulnérables. Il n’est pas raisonnable d’affirmer que la période des 0-2 ans (quand la plupart des vaccins sont administrés) est une période qui aurait une résistance unique aux troubles provoqués par l’activation immunitaire : aucune preuve ne suggère cela. Toutes les preuves suggèrent le contraire.
Les expériences d’activation immunitaire et les études de cas sont cohérentes et indiquent que l’activation immunitaire et le taux élevé de cytokines pendant la période post-natale, peut causer des lésions cérébrales.
La prochaine question cruciale à examiner est de savoir si les vaccins peuvent provoquer une activation immunitaire et une augmentation des cytokines dans le cerveau.
La Vaccination Post-natale affecte le développement cérébral dans les modèles animaux.
La première étude à tester les effets de la vaccination post-natale sur le développement cérébral a été publiée en 2015 (Li 2015). Dans cette expérience, des rats nouveaux-nés ont reçu le vaccin BCG, le vaccin hépatite B (HBV) ou une combinaison des deux (BCG+HBV) avec un calendrier imitant le calendrier vaccinal des enfants. Le BCG et le HBV produisirent des effets opposés sur le cerveau.
En effet, le BCG a renforcé la plasticité synaptique et la Potentialisation à Long Terme (PLT, nécessaire à l’apprentissage et à la mémoire). Le HBV a inhibé la plasticité cérébrale et la PLT. Le BCG et le HBV ont également causé des changements opposés dans les niveaux de certaines protéines synaptiques. Le vaccin HBV a augmenté l’expression du gène de l’IL-6 dans le cerveau (ce que n’a pas causé le BCG). Une augmentation de l’expression du gène indique probablement une augmentation de l’IL-6 dans le cerveau. Le vaccin anti-hépatite B contient un adjuvant d’aluminium, alors que le BCG n’en contient pas. Ainsi, l’adjuvant d’aluminium pourrait être l’ingrédient responsable de l’augmentation de l’expression du gène de l’IL-6. Voir Fig. 4.
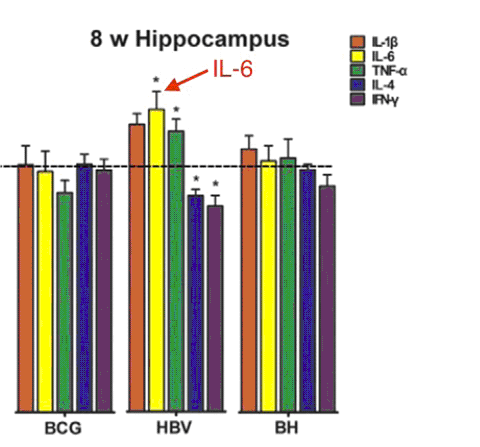
Fig. 4: le vaccin Hépatite B, contrairement au vaccin BCG, augmente l’expression du gène de IL-6 dans le cerveau, 8 semaines après la vaccination à la naissance. Le vaccin Hépatite B contient de l’adjuvant d’aluminium. Le BCG n’en contient pas. Un taux élevé d’IL-6 cause des comportements autistiques dans les modèles animaux. *P<0.05 Adapté de Li et al 2015.
L’étude de Li 2015 montre que les vaccins causent d’autres changements dans le cerveau, dont :
- Des changements dans la PLT (Potentialisation à Long Terme) car le vaccin Hépatite B réduit la PLT
- Des modifications des épines dendritiques
- Des changements dans l’expression des protéines des synapses.
Les modifications des protéines de synapses et des épines dendritiques ont été observées dans les neuropathologies humaines (Toro,2010, Selkoe 2002, Spires 2005, Penzes 2011). Li et al. attribuent ces changements dans le cerveau aux modifications dans les taux de cytokines et à la polarisation immunitaire (polarisation lymphocytaire Th1/Th2) induite par les vaccins. Les adjuvants d’aluminium causent une polarisation Th2. Li et al. déclarent que les résultats de l’étude suggèrent que les vaccins peuvent interagir par le biais des effets de l’activation immunitaire.
«Nos données suggèrent que les combinaisons de vaccins différents peuvent interagir mutuellement (en renforçant ou en inhibant). Le mécanisme de la modulation de la plasticité synaptique par la vaccination néo-natale BSG/HPV peut être accompagné, via les biais systémiques Th1/Th2, par un profile spécifique de cytokines et de neurotrophines dans le cerveau. » (Li 2015)
Li 2015 démontre que les vaccins affectent le développement du cerveau par le mécanisme d’activation immunitaire. De plus, du fait que les adjuvants d’aluminium induisent une activation Th2 et une Polarisation à Long Terme Th2, les résultats de l’étude de Li 2015 suggèrent que tous les vaccins qui contiennent des adjuvants d’aluminium peuvent causer des effets indésirables similaires au vaccin Hépatite B. Par conséquent, les résultats de l’étude de Li 2015 suggèrent que les études démontrant que l’activation immunitaire cause des troubles neurologiques/psychiatriques, sont pertinentes pour les effets indésirables des vaccins.
Les Vaccins sont administrés pendant la phase de formation des synapses
Une autre façon de comprendre pourquoi le cerveau est vulnérable à l’activation immunitaire est de considérer les phases de développement du cerveau qui se produisent pendant le calendrier vaccinal. Les vaccins sont principalement administrés pendant les 18 mois qui suivent la naissance. Le cerveau humain subit un intense et rapide développement durant cette période. La Synaptogénèse (formation des synapses qui connectent les neurones entre eux) est particulièrement intense pendant cette période.
La vulnérabilité du cerveau en développement face à l’activation immunitaire est apparemment liée aux phases spécifiques de développement du cerveau (Tau 2010, Meyer 2006, Meyer 2007). Ces processus comprennent la migration (mouvement des neurones vers leur localisation finale dans le cerveau), l’adhésion (formation des liaisons chimico-mécaniques des cellules cérébrales), et la synaptogénèse (formation des synapses, les connexions entre neurones), entre autres (neurogénèse, gliogénèse, myélinisation…)
Les cytokines affectent les mécanismes de développement du cerveau. Par exemple, un taux élevé d’IL-6 affecte la migration, l’adhésion et la synaptogénèse (Wei 2011). Un taux élevé d’IL-6 après la naissance produit en excès des synapses excitatrices et en défaut, des synapses inhibitrices, donnant lieu à des comportements autistiques (Wei 2012(a)). Chez l’humain, un développement spectaculaire de la synaptogénèse débute à la naissance et continue jusqu’à l’âge de 3 ans (Huttenlocher 1997, Tau 2010, Stiles 2010, Semple 2013). Les vaccins sont donc administrés pendant cette intense formation des synapses. Voir fig. 5-6. Un taux élevé d’IL-6 dans le cerveau produit par la vaccination pendant la formation des synapses peut causer un déséquilibre excitateur-inhibiteur, penchant vers l’excitation. Un déséquilibre excitateur est observé dans l’autisme humain (Robertson 2016, Freyberg 2015).
La synaptogénèse diminue pendant l’enfance et l’adolescence. Ce fait pourrait expliquer pourquoi certains enfants plus âgés, voire des adolescents, peuvent souffrir de régression autistique après une inflammation cérébrale intense, mais deviennent moins vulnérables à l’activation immunitaire cérébrale avec l’âge.
Les vaccins sont donc administrés pendant une période d’intense synaptogénèse (0-18 mois). Par conséquent, les vaccins peuvent avoir un impact indésirable sur la formation des synapses s’ils produisent des inflammations ou IL-6 dans le cerveau. Le timing du développement cérébral des humains soutient l’idée que le cerveau humain est vulnérable à l’activation immunitaire et aux cytokines pendant les premières années de vie, quand les vaccins sont massivement administrés. La perturbation de la synaptogénèse par une activation immunitaire vaccinale est très préoccupante.
(Remarque : c’est la raison pour laquelle le bébé est naturellement peu sensible aux inflammations, raison pour laquelle on ajoute des adjuvants aux vaccins…)

Fig. 5: Phases de développement du cerveau humain. La Formation des Synapses (Synaptogénèse) est très intense pendant les 2 premières années de vie, quand les vaccins sont administrés (le calendrier vaccinal américain est proche du calendrier vaccinal français, à l’exception de l’Hépatite B le jour de la naissance). Un taux élevé d’IL-6 pendant la synaptogénèse peut causer un déséquilibre entre les synapses excitatrices et inhibitrices, favorisant les excitatrices. Adapté de Semple 2013

Fig. 6: les mesures des densités de synapses dans les cerveaux de cadavres humains, à différents âges, indique un développement spectaculaire de la synaptogénèse pendant les premières années de vie. Les vaccins sont administrés pendant une intense formation des synapses. Un taux élevé d’IL-6 pendant cette synaptogénèse peut causer un déséquilibre entre les synapses excitatrices et inhibitrices, favorisant les excitatrices. Image adaptée de Huttenlocher and Dabholkar 1997.
Les Adjuvants d’Aluminium sont Neurotoxiques aux doses vaccinales.
Les Adjuvants d’Aluminium (Al) jouent un rôle essentiel dans de nombreux vaccins : ils stimulent l’activation immunitaire. Sans Adjuvants d’Aluminium, ces vaccins auraient une efficacité moindre.
Les Adjuvants d’Aluminium sont formés de nanoparticules de composés d’aluminium, typiquement AlOH, AlPO4, AlSO4 ou des mélanges. Ces nanoparticules s’agglomèrent pour former de grosses particules de l’ordre de 2-20 micromètres (Harris 2012). L’adjuvant d’aluminium est très peu soluble dans l’eau ou les fluides du corps humain. Ces particules d’aluminium sont très biopersistantes et peuvent rester dans le corps pendant des mois, voire des années. (Flarend 1997, Khan 2013, Gherardi 2001).
L’Aluminium de l’alimentation (sous forme soluble Al3+, non particulaire) a une absorption orale très faible (de l’ordre de 0,1% selon l’EFSA), il est rapidement éliminé par les reins et est en grande partie maintenu à l’extérieur du cerveau par la Barrière Hémato-Encéphalique. Ces défenses naturelles, pour peu qu’elles fonctionnent normalement et qu’elles soient matures (ce n’est pas le cas du nourrisson), sont capables de protéger le cerveau contre les niveaux d’aluminium auxquels nous sommes naturellement exposés.
Au contraire, ces défenses naturelles ne parviennent pas à protéger le cerveau contre les particules d’adjuvants d’aluminium qui sont injectées directement dans l’organisme. Ces particules sont trop grosses pour être éliminées par les reins (surtout chez le nourrisson dont la fonction rénale est immature, les 6 premiers mois en moyenne).
Ces particules sont surtout transportées dans le cerveau par le biais des cellules immunitaires, les macrophages, qui agissent comme un « cheval de Troie ».
Voici les doses que reçoivent les nourrissons selon les calendriers vaccinaux américains et français les premiers mois (doses maximales, car les vaccins n’ont pas tous le même dosage) :
Naissance
USA : (Hep B) : 74 mcg/kg (250 mcg for 3.4 kg infant)
2 mois :
USA : 245 mcg/kg (1225 mcg pour une nourrisson de 5 kg)
France : 189 mcg/kg (945 mcg pour un nourrisson de 5 kg)
4 mois :
USA : 150 mcg/kg (975 mcg pour un nourrisson de 6.5 kg)
France : 145 mcg/kg (945 mcg pour un nourrisson de 6,5 kg)
5 mois :
France : 66 mcg/kg (500 mcg pour un nourrisson de 7,5 kg)
6 mois :
USA : 153 mcg/kg (1225 mcg pour 8 kg)
11 mois :
France : 105 mcg/kg (945 mcg pour un nourrisson de 9 kg)
De plus en plus de preuves montrent que les adjuvants d’Aluminium ont des effets neurologiques indésirables à des doses inférieures ou égales aux doses que reçoivent les enfants par la vaccination. Ces effets semblent dépendants du caractère particulaire et de la biopersistance des adjuvants d’Aluminium (qui n’est quasiment pas éliminé du corps au cours du temps). L’Aluminium injecté a des effets indésirables dépendants de la forme particulaire (toxicité particulaire) et non par les ions Al3+ (toxicité chimique liée à la dose) résultants de la lente dissolution des particules (Crépeaux 2017).
Les injections d’adjuvants d’Aluminium chez la souris causent des effets indésirables à des doses que l’on trouve dans les vaccins : 100, 200, 300 and 550 mcg/Kg de poids corporel (Crépeaux 2017, Shaw 2009, Petrik 2007, Shaw 2013). Cela inclut des déficits dans l’apprentissage et la mémoire (Shaw 2009), déficits dans la force et la fonction neuromusculaire (Petrik 2007), et des changements dans l’activité et/ou la démarche locomotrice (Shaw 2009, Shaw 2013). L’autisme est associé aux anomalies de déemarche et de mouvement (Kindregan 2015) et de dysfonctionnement de la mémoire (Williams 2006).

Fig. 7: Les doses de 300mcg/Kg d’hydroxyde d’Aluminium (AlOH) ont causé des changements importants et persistants dans le comportement exploratoire et dans les mouvements des tests de champ ouvert. Ceci est une indication de neurotoxicité. Les Humains autistes aussi ont des mouvements et un comportement exploratoire anormaux. Adapté de Shaw et Petrik 2009.
Les doses d’adjuvants d’Aluminium de 200 mcg/Kg (3 x 66 mcg/Kg dans l’étude de Crépeaux 2017) et 300 mcg/Kg (6 x 50 mcg/Kg) (Shaw 2009) accentuèrent l’activation de la microglie dans le cerveau antérieur et la moelle épinière lombaire, respectivement. Cette activation intense de la microglie fut mesurée 6 mois après l’injection des adjuvants d’aluminium, ce qui suggère que l’activation microgliale est chronique. L’activation de la microglie indique un processus inflammatoire en cours et suggère la présence d’un haut taux de cytokines. Les autistes humains ont une microglie activée et des taux de cytokines élevés dans tout le cerveau (Vargas 2005, Suzuki 2013, Li 2009).
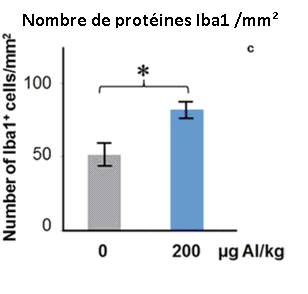
Fig. 8: Les Adjuvants d’Aluminium (200 mcg/Kg) ont causé une accentuation de l’activation microgliale dans le cerveau des souris. La protéine Iba1 indique que la microglie est active. Les mesures furent prises 6 mois après l’injection des Adjuvants d’Aluminium, ce qui indique une activation chronique de la microglie. * P<0.05. Crépeaux et al., 2017.

Fig. 9: Les Adjuvants d’Aluminium (300 mcg/Kg) ont causé une accentuation de l’activation microgliale dans la moelle épinière lombaire des souris. La protéine Iba1 indique que la microglie est active. Les mesures furent prises 6 mois après l’injection des Adjuvants d’Aluminium, ce qui indique une activation chronique de la microglie. ***p < 0.001, Shaw and Petrik 2009.
Une microglie active est un facteur causal de l’autisme, car la microglie produit l’inflammation dans le cerveau. La microglie peut produire IL-6 quand elle est activée. Takano 2015, une étude sur le lien entre microglie et autisme affirme :
« … tout facteur capable de modifier le nombre ou l’activation de la microglie, soit in utero soit durant la période post-natale, peut affecter profondément le développement neurologique, et ainsi produire un trouble neuro-développemental, dont l’autisme » (Takano 2015)
La microglie semble jouer un rôle crucial dans la causalité de l’autisme (Takano 2015, Kneusel 2014). Par conséquent, l’activation de la microglie par les adjuvants d’Aluminium suggère son rôle dans l’Autisme. Plusieurs études démontrent que les Adjuvants d’Aluminium augmentent la teneur en aluminium du cerveau (Crépeaux 2017, Flarend 1997, Shaw 2009, Khan 2013, Crépeaux 2015). Une dose de 200 mcg/Kg d’Adjuvant d’Aluminium ont causé une augmentation d’un facteur 50, de la teneur en aluminium du cerveau des souris, de 0.02 μg/g à 1.0 μg/g de poids sec du cerveau (Crépeaux 2017). Ces mesures ont été effectuées 6 mois après l’injection finale, indiquant que l’Aluminium reste dans le cerveau pendant longtemps (Crépeaux 2017). Voir Fig. 10. Les Adjuvants d’Aluminium s’accumulent dans le cerveau des souris, jusqu’à un an après l’injection (Khan 2013). Crépeaux 2015 a démontré que la persistance et l’accumulation progressive des particules d’Adjuvants d’Aluminium, pouvaient durer jusqu’à 270 jours dans la rate et les ganglions lymphatiques des souris.
L’accumulation progressive d’Aluminium dans des organes distants au cours du temps, suggère que les effets toxiques pourraient augmenter avec le temps, et pourraient être retardés pour survenir des mois voire des années après l’exposition. Les doses de 400 et 800 mcg/Kg utilisés dans Crépeaux 2017 n’ont pas causé d’effets indésirables ou une augmentation des taux d’aluminium dans le cerveau (du moins pendant la durée de l’étude). Les auteurs attribuent cette étonnante relation dose-réponse inversée aux granulomes provoqués par les doses les plus fortes. Les granulomes emprisonnent l’Adjuvant d’Aluminium au site d’injection, empêchant ainsi son transport jusqu’aux autres organes sensibles, dont le cerveau. Les granulomes apparaissent après 1% des vaccinations (Bergfors 2014). Cette information est préoccupante car cela indique que pour 99% des vaccinations, l’Adjuvant d’Aluminium peut être transporté ailleurs dans l’organisme. Il n’est pas emprisonné dans le granulome. Voir Fig. 11.

Fig. 10: Les Doses d’Adjuvant d’Aluminium de 200 mcg/Kg ont causé une augmentation d’un facteur 50 des teneurs en aluminium du cerveau des souris, passant de 0.02 à 1.00 μg/g de poids sec de cerveau. Les plus hautes doses (400 et 800 mcg/Kg) n’ont pas augmenté la teneur en aluminium du cerveau, probablement du fait que les plus fortes doses causent des granulomes au site d’injection. Un granulome emprisonne l’aluminium au site d’injection, l’empêchant de migrer dans l’organisme, et donc d’entrer dans le cerveau. Ces mesures ont été faites 6 mois après l’injection finale, indiquant que l’Aluminium persiste longtemps dans le cerveau *P<0.05. Crépeaux et al., 2017.
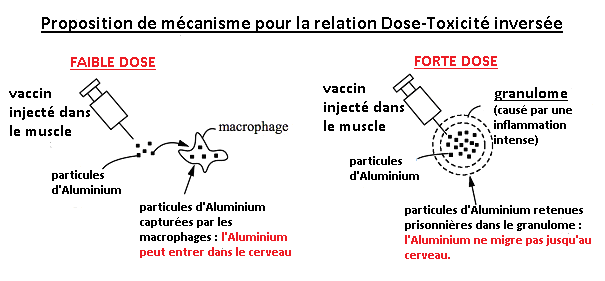
Fig. 11: Les fortes doses d’Adjuvant d’Aluminium injectées dans le muscle provoquent des granulomes qui emprisonnent l’Adjuvant d’Aluminium et l’empêchent de migrer jusqu’au cerveau. Les faibles doses ne provoquent pas de granulomes. Ainsi, les faibles doses peuvent migrer jusqu’au cerveau et sont donc plus toxiques que les fortes doses. Ce mécanisme explique l’étonnante « dose-réponse » inversée obtenue dans l’étude de Crépeaux 2017.
Le Transport de Particules et la Chemokine Ligand 2 (CCL2) / Macrophage Chemoattractant Protein (MCP-1)
Les Adjuvants d’Aluminium entrent dans le cerveau (Khan 2013, Crépeaux 2015, Crépeaux 2017, Shaw 2009, Flarend 1997). Les particules d’Adjuvants d’Aluminium sont transportées par les macrophages à travers la Barrière Hémato-Encéphalique, dans le cerveau (Khan 2013). Ce transport est favorisé par les chemokines CCL2/MCP1 (Khan 2013).
Les CCL2/MCP1 attirent les macrophages, les font migrer dans l’organisme et entrer dans le cerveau. Le transport des particules dans le cerveau est maintenant bien établi et est utilisé dans certains traitements thérapeutiques (Choi 2012, Pang 2016).
Le taux de CCL2/MCP1 est élevé dans les cerveaux de personnes autistes (Vargas 2005) et dans le sang des nouveaux-nés qui sont diagnostiqués plus tard pour l’autisme (Zerbo 2014). Cela suggère que les nouveaux-nés qui ont des taux élevés de CCL2/MCP1 vont connaître une pénétration cérébrale de l’aluminium plus importante quand on leur injectera des vaccins contenant des Adjuvants d’Aluminium. Cette information est cohérente avec le fait que les adjuvants d’aluminium provoquent l’autisme en produisant une activation immunitaire dans le cerveau.
L’Aluminium produit l’expression de IL-6 dans le cerveau
Les sels d’Aluminium solubles (par exemple AlCl3, lactate d’aluminium) produisent un taux élevé d’IL-6 dans le cerveau et autres tissus. En effet, l’Aluminium semble produire de manière sélective IL-6 (Viezeliene 2013). Les études portant sur l’exposition à l’aluminium et l‘expression de IL-6 dans le cerveau incluent :
- Cao 2016 : Une Ingestion de 30 ou 90 mg/kg/jour d’aluminium soluble (AlCl3) pendant 90 jours augmente significativement l’expression du gène IL-6 et d’autres cytokines dans le cerveau (hippocampe).
- Alawdi 2016 : Une Ingestion de 3,4 mg/kg/jour d’aluminium soluble (AlCl3) pendant 6 semaines cause une augmentation d’un facteur 4 de IL-6 dans le cerveau (hippocampe). Cette dose est bien plus faible que la NOAEL officielle (« No Observed Adverse Effects Level ») , c’est-à-dire la dose de risque minimal, relative aux doses orales (26 mg/kg/jour), utilisée comme seuil de toxicité (Mitkus 2011), et qui est dépassée. En effet, d’autres expériences montrent que des doses orales de 3.4 – 4 – 5.6 – 6, et 20.2 mg/kg/jour d’aluminium causent de nombreux effets indésirables chez la souris ou le rat, et donc, la véritable NOAEL pour l’Aluminium ingéré est encore inconnue (Alawdi 2016, Dera 2016, Sethi 2008, Sethi 2009, Bilkei-Gorzo 1993). La production de IL-6 peut survenir car l’Aluminium provoque un stress oxydatif (Exley 2003). Le stress oxydatif induit l’expression de IL-6 (Viezeliene 2013).
Le Site des CDC cite une étude complètement erronée concernant les Adjuvants d’Aluminium (Mitkus 2011)
Les doses d’adjuvants d’Aluminium que reçoivent les nourrissons ont considérablement augmenté depuis l’extension du calendrier vaccinal pendant les années 80 et 90. Mais alors que l’extension du calendrier vaccinal amplifiait les doses d’Aluminium injecté, aucune étude ne fut conduite concernant l’innocuité de l’Aluminium.
Les agences gouvernementales concernées (HHS, NIH, CDC, FDA) ne commandèrent pas d’études supplémentaires sur la toxicité des Adjuvants d’Aluminium. Pour toute garantie de ces nouveaux dosages, les CDC se réfèrent à une étude de 2011 de la FDA : Mitkus 2011.
Cette étude est la seule preuve scientifique de l’innocuité des adjuvants d’aluminium vaccinaux avancée par les sites internet du CDC et le FDA.
L’étude de Mitkus 2011 est une étude théorique sur la pharmacocinétiques des Adjuvants d’Aluminium : elle met à jour l’étude de Keith 2002, mais ne consulte aucune nouvelle donnée sur le sujet (pas de nouvelle étude sur cobaye, pas d’étude épidémiologique.) Mitkus 2011 calcule une charge corporelle d’Aluminium issue de la dissolution des particules d’Aluminium des adjuvants et compare cette charge d’aluminium dissout à un « niveau de risque minimal » ou « niveau de sécurité » (Minimal Risk Level en anglais). Le MRL a été déterminé suite à une étude consacrée à la toxicité de l’aluminium ingéré par des souris (Golub 2001).
L’étude de Golub 2001 fournit une dose sans effet nocif observable (NOAEL) de 26 mg/kilo/jour d’aluminium ingéré, converti en 1 mg/kg/jour pour les humains, dont les nourrissons, car l’ATSDR américaine applique un facteur de sécurité de 1/30 pour déterminer le « niveau de risque minimal / MRL ».
Notons qu’en Europe, l’EFSA applique un facteur de sécurité de 1/100 pour déterminer la MRL, pour l’aluminium. Ainsi, une NOAEL (dose sans effet) de 10 mg/kg/jour a donné la MRL de 0,1 mg/kg/jour, soit 10 fois moins que la Dose Tolérable Journalière américaine (1 mg/kg/jour)… On comprend bien que la MRL est un concept hautement théorique, qui dépend totalement du bon vouloir des autorités sanitaires : chacune a en effet la sienne…
L’étude de Mitkus est complètement erronée pour 3 raisons majeures:
1) Mitkus part du principe que les particules d’Adjuvants d’Aluminium sont inoffensives.
Mitkus suppose abusivement que les Adjuvants d’Aluminium n’ont aucune toxicité lorsqu’ils sont sous forme particulaire. Mitkus considère seulement la toxicité potentielle des ions d’aluminium (Al3+), lentement relâchés par les Adjuvants d’Aluminium lors de leur lente dissolution. Or les Adjuvants d’Aluminium sont formés de particules microscopiques, extrêmement bio-persistantes car très peu solubles.
L’étude de Mitkus suppose que les particules sont par nature non-toxiques et complètement inoffensives, même lorsqu’elles sont présentes dans le cerveau, ou d’autres organes (alors qu’elles sont justement utilisées dans le vaccin pour leur capacité à provoquer des inflammations). Mitkus ne présente aucune justification quant à cette supposition implicite, ce qui est d’autant plus alarmant lorsqu’on constate que les dernières recherches (Crépeaux 2017) sur le sujet contredisent clairement ce postulat et sonnent l’alerte au sujet du danger de la toxicité des particules fines.
Les particules d’aluminium peuvent avoir un effet toxique selon leur chimie de surface (la charge de surface et l’activité catalytique de la surface), la forme de la particule, ainsi que d’autres caractères spécifiques aux particules solides (Sharifi 2012, Podila 2013).
Plusieurs études montrent que l’Adjuvant d’Aluminium injecté peut provoquer des troubles du comportement, une prise de poids anormale, des troubles de l’apprentissage et de la mémorisation, la mort de neurones moteurs (apoptose), des déficits du tonus musculaire, une activation chronique de la microglie (inflammation cérébrale), et une considérable (facteur 50x) accumulation d’Aluminium dans le cerveau et la moelle épinière (Petrik 2007, Shaw 2009, Shaw 2013, Crepeaux 2017). Ces effets indésirables peuvent apparaître à des doses plus faibles ou identiques à celles administrées aux nourrissons selon le calendrier vaccinal des CDC.
2) De nouvelles recherches indiquent des effets néfastes à partir de doses nettement inférieures à 26 mg/Kg/Jour
Mitkus suppose que la toxicité des Adjuvants d’Aluminium est uniquement déterminée par la quantité d’ions Al3+ relâchés dans l’organisme lors de la dissolution des particules d’Adjuvants d’Aluminium. Pour établir un seuil de toxicité pour l’Aluminium soluble, Mitkus se réfère à une étude sur l’ingestion d’aluminium chez la souris (Golub 2001) rapportant une « dose sans effet nocif observable » de 26mg/kg/jour d’aluminium ingéré.
Mitkus applique un taux de conversion de 1/30 pour adapter cette dose à l’être humain, ce qui semble raisonnable. Cependant, d’autres expériences montrent qu’avec des dosages inférieurs de 3,4 / 4 / 5,6 / 6 et 20.2 mg/kg/jour, l’aluminium provoque déjà des effets indésirables chez les souris et les rats. (Alawdi 2016, Dera 2016, Sethi 2008, Sethi 2009, Bilkei-Gorzo 1993). Ces effets indésirables incluent des inflammations chroniques du cerveau, des troubles de l’apprentissage et de la mémorisation et une inflammation des reins.
Donc l’analyse de Mitkus est faussée par l’utilisation d’une dose de sécurité de 26mg/kilo/jour bien trop élevée : ce n’est pas une dose sans effet nocif observable (NOAEL). Le niveau de risque minimal (MRL) déterminé par Mitkus est trop haut d’au moins 26/3.4 = 7.6.
Notons que l’European Food Security Authority (EFSA) en Europe a adopté un MRL de 0,1 mg/kg/jour (pour une NOAEL de 10 mg/kg/jour). Donc si l’on applique le MRL européen à l’étude de Mitkus, la charge en aluminium des nourrissons dépasse les niveaux de sécurité pendant au moins la première année de vie.
En effet, si on se réfère à une dose sans effet nocif observable (NOAEL) de 3.4 mg/kilo/jour pour le rat (basé sur Alawdi 2016) équivalent à un MRL américain de 0,11 mg/kg/jour, ou bien si l’on se réfère à un chiffre plus officiel, le MRL officiel de l’Europe (0,1 mg/kg/jour), alors les doses d’adjuvants de Phosphate d’Aluminium (AIPO4) contenus dans les vaccins dépassent la dose minimale de sécurité – et est plus ou moins au niveau des doses d’Hydroxyde d’Aluminium (AlOH). Le nouveau seuil de sécurité indique que l’adjuvant de Phosphate d’Aluminium (Fig 12) et l’adjuvant d’Hydroxyde d’Aluminium (Fig. 13) peuvent être déjà toxiques si on ne tient compte que de l’aluminium solubilisé, si l’on respecte le calendrier vaccinal des CDC. Notons que la dose de 3,4 mg/kilo/jour N’EST PAS une NOAEL puisque Alawdi constate des effets indésirables déjà à cette dose. La NOAEL réelle est forcément inférieure, et n’est pas connue à ce jour. Voir les figures 12 et 13.
(Remarque : pour le spécialiste mondial de la toxicité de l’Aluminium, le Pr Exley, il ne peut exister de dose minimale d’Aluminium sans risque, notamment pour le nourrisson).

Fig. 12: La Charge corporelle en aluminium issue de la dissolution du Phosphate d’Aluminium (AlPO4) dépassent le niveau de sécurité corrigé selon les dernières mesures (Alawdi 2016) qui déterminent qu’une ingestion de 3,4 mg/kg/jour d’aluminium peut causer des effets indésirables chez la souris. La charge corporelle d’aluminium dépasse la ligne du niveau de sécurité pendant la première année de vie, indiquant une possible toxicité. ATTENTION, la toxicité des particules d’adjuvant d’Aluminium (toxicité relative aux particules fines) est une toxicité à part qui s’additionne à la toxicité de l’ion Al3+ (toxicité chimique classique relative à la dose).
La MRL 50 et la MRL 5 sont les niveaux de Sécurité qui se réfèrent aux deux courbes de croissance des nourrissons. Adapté de l’étude de Mitkus et al., 2011.
REMARQUE : le niveau de sécurité pour l’aluminium ingéré, adopté par l’European Food Security Agency (EFSA) est encore inférieur à la dose déterminée par Alawdi (soit un MRL/ Niveau de sécurité d’environ 0,1 mg/kg/jour pour l’humain).
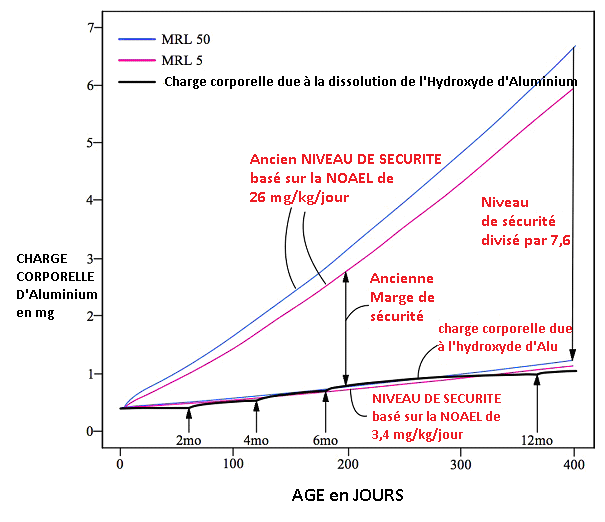
Fig. 13: Charge corporelle d’aluminium issue de la (très faible) dissolution de l’Hydroxyde d’Aluminium (AlOH) avec le niveau de sécurité corrigé selon les dernières mesures (Alawdi 2016) qui déterminent qu’une ingestion de 3,4 mg/kg/jour d’aluminium peut causer des effets indésirables chez la souris. La charge corporelle d’aluminium se superpose à la ligne du niveau de sécurité pendant la première année de vie, indiquant une possible toxicité : il n’y a plus de marge de sécurité. ATTENTION, la toxicité des particules d’adjuvant d’Aluminium est une toxicité à part (toxicité des particules fines) qui s’additionne à la toxicité chimique de l’ion Al3+ relative à la dose.
La MRL 50 et la MRL 5 se réfèrent aux niveaux de sécurités basés sur les deux courbes de croissance des nourrissons. Adapté de l’étude de Mitkus et al., 2011.
REMARQUE : le niveau de sécurité pour l’aluminium ingéré, adopté par l’European Food Security Agency (EFSA) est encore inférieur à la dose déterminée par Alawdi (soit une MRL/Niveau de sécurité de 0,1 mg/kg/jour pour l’humain).
CONCLUSION relative aux doses injectées : le nourrisson est officiellement soumis à des doses toxiques d’aluminium pendant la première année de vie, si l’on respecte le calendrier vaccinal et qu’on applique les niveaux de sécurité européens.
3) MITKUS NE CITE AUCUNE ETUDE SUR LA TOXICITE DES ADJUVANTS D’ALUMINIUM, MALGRE LEUR EXISTENCE
Mitkus ne cite aucune donnée relative à la toxicité de l’Aluminium particulaire injecté. A la place, Mitkus utilise des études portant sur la toxicité de l’Aluminium soluble ingéré, alors que cet aluminium est sous forme soluble non particulaire (Golub 2001 utilise du Lactate d’Aluminium, qui est soluble) pour déterminer le Niveau de sécurité des Adjuvants d’Aluminium (particulaires et injectés). Il ne se base que sur une seule et unique étude (Golub 2001). Etonnamment, Mitkus soutient que les doses d’Adjuvants d’Aluminium injectés aux nourrissons sont sûres sans citer aucune donnée relative à la toxicité des adjuvants d’Aluminium.
Au moins deux études animales portant sur la toxicité des Adjuvants d’Aluminium étaient disponibles avant la publication de Mitkus en 2011 (Petrik 2007, Shaw 2009). Ces études n’ont été ni citées, ni mentionnées par Mitkus 2011.
Remarquons que la publication de Mitkus 2011 est survenue très rapidement après une publication remarquée de l’équipe du Pr Shaw : « Aluminum vaccines Adjuvants : are they safe ? » (Tomljenovic 2011), qui questionne frontalement le manque d’études officielles sur la toxicité des adjuvants, et témoigne des résultats inquiétants des études expérimentales animales qui observent certains effets secondaires graves des adjuvants d’aluminium.
Chacune de ces erreurs est rédhibitoire pour la validité de l’étude de Mitkus et sa tentative d’établir l’innocuité des doses d’Adjuvants d’Aluminium. Ainsi, les CDC manquent cruellement de preuves solides et valides pour établir la sécurité des Adjuvants d’Aluminium. C’est particulièrement préoccupant par rapport aux troubles neurologiques ou à long terme, car d’autres études sur la sécurité des Adjuvants d’Aluminium (Jefferson 2004) ne portent que sur des effets bénins à court terme.
Remarque : c’est probablement la raison pour laquelle la FDA, qui a produit Mitkus 2011, a retiré l’étude de son site, fin 2017, et n’en fait plus mention (contrairement aux CDC). Dans ses archives, la page qui mentionnait Mitkus 2011 est affichée avec la mention «the information on this web page may be out of date » (« les informations sur cette page sont peut-être obsolète »)
Il n’y a donc aucune étude valable, aujourd’hui, capable de démontrer l’innocuité des adjuvants d’Aluminium injectés aux nourrissons.
Les CDC ne parviennent pas à évaluer la toxicité des Adjuvants d’Aluminium
Les CDC n’ont conduient aucune étude épidémiologique à long terme sur la sécurité des Adjuvants d’Aluminium (notamment du point de vue des effets indésirables neurologiques). Il y a une étude écologique qui a étudié des données à l’échelle des Etats-Unis, et qui a reporté une association entre l’exposition aux Adjuvants d’Aluminium et l’Autisme (Tomljenovic 2011).
Remarque : Une étude écologique est une étude épidémiologique dans laquelle les critères analysés concernent une population plutôt que des individus.
Toutefois, les études écologiques sont souvent sujettes aux biais. Le Dr Frank DeStefano du bureau de la sécurité de la Vaccination aux CDC est le co-auteur d’une étude de faisabilité (Glanz 2015) pour savoir si l’on pouvait utiliser la Vaccine Safety Datalink (VSD) pour étudier la sécurité de chaque ingrédient des vaccins pris séparément. L’étude se focalise sur les adjuvants d’Aluminium. Elle reconnaît que le Thimerosal est le seul ingrédient des vaccins à avoir été étudié en relation à l’Autisme, ou aux troubles neurologiques, et qu’une possible association entre les Adjuvants d’Aluminium et l’Autisme n’a pas été étudiée dans les études épidémiologiques.
Glanz 2015 affirme :
« A ce jour, il n’y a pas eu d’étude basée sur la population, spécifiquement élaborée pour évaluer les associations entre les résultats cliniques significatifs et les ingrédients non-antigèniques, autres que le Thimérosal. »
Toutefois, l’étude de Glanz note que les études officielles portant sur les Adjuvants d’Aluminium sont problématiques du fait de la faible différence d’exposition dans les groupes tests (« haute exposition) et les groupes contrôles (« faible exposition »). Glanz 2015 conclut
« … les enfants sous le 10ème percentile seraient exposés à des doses allant de 0 à 3,1 mg d’aluminium, alors que les enfants au-dessus du 90ème percentile seraient exposés à des doses allant de 4,8 mg à 5,3 mg d’aluminium, provenant des vaccins. On ignore si de telles différences dans l’exposition à l’aluminium seraient biologiquement significatives. » (Glanz 2015).
Donc, les études épidémiologiques pourraient ne pas fournir des preuves fiables concernant la sécurité ou les dommages. De l’utilisation des adjuvants d’Aluminium.
Notons que les modèles animaux pourraient nous en apprendre beaucoup sur les effets indésirables des adjuvants d’Aluminium.
Les CDC n’ont pas étudié les problèmes de sécurité liés aux Adjuvants d’aluminium, malgré des preuves scientifiques de plus en plus nombreuses que ceux-ci sont un danger, preuves qui lient les Adjuvants d’Aluminium aux mécanismes d’activation immunitaire des lésions cérébrales.
Conclusion
La science passée en revue dans ce papier raconte une histoire cohérente et convaincante : les vaccins peuvent causer l’autisme en stimulant l’activation immunitaire et les taux élevés de cytokines dans le cerveau. Les Adjuvants d’Aluminium sont impliqués comme cause de l’autisme car ils peuvent être transportés dans le cerveau (par les macrophages), où ils causent une activation microgliale aux doses présentes dans les vaccins, car l’Aluminium peut produire IL-6 dans le cerveau.
Dans les déclarations affirmant qu’il n’existe pas de lien entre autisme et vaccination, les CDC citent des preuves scientifiques qui ne sont pas pertinentes pour assurer la sécurité des Adjuvants d’Aluminium, ou sont incapables de réfuter le lien entre Adjuvants d’Aluminium et Autisme (Taylor 2014, DeStefano 2013, Mitkus 2011). A l’appui des revendications de la sécurité des Adjuvants d’Aluminium, les CDC s’appuient sur une seule étude théorique de modélisation, erronée et biaisée (Mitkus 2011). Il n’y a pas de preuve scientifique permettant d’affirmer l’innocuité des Adjuvants d’Aluminium, en particulier dans leur lien avec l’Autisme, et d’autres troubles neurologiques à long terme.
Références
Akintunde et al., 2015 Increased production of IL-17 in children with autism spectrumdisorders and co-morbid asthma, Journal of Neuroimmunology 286 (2015) 33-41.
Al-Ayadhi et al., 2012 Elevated serum levels of interleukin-17A in children with autism, Journal of Neuroinflammation 2012, 9:158.
Alawdi et al., 2016 Neuroprotective Effect of Nanodiamond in Alzheimer’s Disease Rat Model: a Pivotal Role for Modulating NF-κB and STAT3 Signaling, Molecular Neurobiology, 54 (3):1906-1918.
Atladottir et al., 2010 Maternal infection requiring hospitalization during pregnancy and autism spectrum disorders, Journal of Autism and Developmental Disorders, 2010 Dec;40(12):1423-1430.
Bauman et al., 2014 Activation of the Maternal Immune System During Pregnancy Alters Behavioral Development of Rhesus Monkey Offspring, Biological Psychiatry, 2014;75: 332–341
Bergfors et al., 2014 How common are long-lasting, intensely itching vaccinationgranulomas and contact allergy to aluminium induced by currently used pediatric vaccines? A prospective cohort study, European Journal of Pediatrics, 173:1297–1307.
Bilkei-Gorzo, 1993, Neurotoxic effect of enteral aluminum, Food and Chemical Toxicology, 31(5):357-361.
Brown et al., 2014 Metabolic consequences of interleukin-6 challenge in developing neurons and astroglia, Journal of Neuroinflammation, 11:183.
Brown et al., 2012 Epidemiologic studies of exposure to prenatal infection and risk of schizophrenia and autism, Developmental Neurobiology, 2012 October ; 72(10): 1272–1276.
Bruce et al., 2011 Converging pathways lead to overproduction of IL-17 in the absence of vitamin D signaling, 2011 Aug; 23(8): 519–528.
Careaga et al., 2017 Maternal Immune Activation and Autism Spectrum Disorder: From
Rodents to Nonhuman and Human Primates, Biological Psychiatry, March 1, 2017; 81:391–401.
Chen et al., 2013 Postnatal systemic inflammation exacerbates impairment of hippocampal
synaptic plasticity in an animal seizure model, Neuroimmunomodulation, 2013;20(4):223-32.
Choi et al., 2012, Delivery of nanoparticles to brain metastases of breast cancer using a cellular Trojan horse, Cancer Nanotechnology, 3:47–54.
Choi et al., 2016 The maternal interleukin-17a pathway in mice promotes autismlike phenotypes in offspring, Science, 2016 Feb 26; 351(6276): 933–939.
Ciaranello et al., 1995 The Neurobiology of Infantile Autism, The Neuroscientist, 1:361-367
Coiro et al., 2015 Impaired synaptic development in a maternal immune activation mouse model of neurodevelopmental disorders, Brain, Behavior, and Immunity, Nov;50:249-258.
Crépeaux et al., 2015 Highly delayed systemic translocation of aluminum-based adjuvant in CD1 mice following intramuscular injections, Journal of Inorganic Biochemistry, 152:199-205.
Crépeaux et al., 2017 Non-linear dose-response of aluminium hydroxide adjuvant particles: Selective low dose neurotoxicity, Toxicology, 375 (2017) 48–57.
DeLong et al., 1981 Acquired reversible autistic syndrome in acute encephalopathic illness in children, Archives of Neurology, 36:191-194.
Dera 2016, Protective effect of resveratrol against aluminum chloride induced nephrotoxicity in rats, Saudi Medical Journal, 37 (4).
DeStefano et al., 2013 Increasing Exposure to Antibody-Stimulating Proteins and Polysaccharides in Vaccines Is Not Associated with Risk of Autism, The Journal of Pediatrics, 163 (2).
Deverman and Patterson, 2009 Cytokines and CNS Development, Neuron 64:61-78.
Drozdenko et al., 2014 Oral vitamin D increases the frequencies of CD38+ human B cells and ameliorates IL-17-producing T cells, Experimental Dermatology, 23: 107-112.
Estes and McAllister, 2016 Maternal immune activation: implications for neuropsychiatric disorders, Science, 353 (6301) 772-777.
Exley, 2003 The Pro-Oxidant Activity of Aluminum, Free Radical Biology and Medicine, 36(3): 380-387.
Flarend et al., 1997 In vivo absorption of aluminum-containing vaccine adjuvants using 26 Al, Vaccine, 15(12/13):1314-1318.
Freyberg et al., 2015 Reduced perceptual exclusivity during object and grating rivalry in autism, Journal of Vision, 15(13):11, 1–12.
Galic et al., 2008 Postnatal Inflammation Increases Seizure Susceptibility in Adult Rats, The Journal of Neuroscience, 2008, 28 (27) 6904-6913.
Garay et al., 2013 Maternal immune activation causes age- and region-specific changes in brain cytokines in offspring throughout development, Brain, Behavior, and Immunity, 31: 54-68.
Ghaziuddin et al., 2002 Autistic symptoms following herpes encephalitis, European Child and Adolescent Psychiatry, Vol. 11, No. 3:142-146.
Gherardi et al., 2001 Macrophagic myofasciitis lesions assess long-term persistence of vaccine-derived aluminium hydroxide in muscle, Brain, 124:1821-1831.
Ghiani et al., 2011 Early effects of lipopolysaccharide induced inflammation on foetal brain development in rat, ASN Neuro, 3 (4): 233-245.
Gillberg 1986 Brief Report: Onset at Age 14 of a Typical Autistic Syndrome. A Case Report of a Girl with Herpes Simplex Encephalitis, Journal of Autism and Developmental Disorders, VoL 16, No. 3:369-375.
Giulivi et al 2013 Gestational Exposure to a Viral Mimetic Poly(I:C) Results in Long-Lasting Changes in Mitochondrial Function by Leucocytes in the Adult Offspring, Mediators of Inflammation, Vol 2013:609602.
Glanz et al., 2015, Cumulative and episodic vaccine aluminum exposure in a population based cohort of young children, Vaccine 33:6736–6744.
Golub et al., 2001 Long-term consequences of developmental exposure to aluminum in a suboptimal diet for growth and behavior of Swiss Webster mice, Neurotoxicology and Teratology 23 (2001) 365–372.
Gupta et al., 1998 Th1- and Th2-like cytokines in CD4+ and CD8+ T cells in autism, Journal of Neuroimmunology, 85:106-109.
Harre et al., 2008 Neonatal inflammation produces selective behavioural deficits and alters N-methyl-D-aspartate receptor subunit mRNA in the adult rat brain, European Journal of Neuroscience, 2008 Feb; 27(3): 644–653.
Harris et al., 2012 Alhydrogel® adjuvant, ultrasonic dispersion and protein binding: A TEM and analytical study, Micron, 43:192-200.
Hsiao et al., 2013 The microbiota modulates gut physiology and behavioral abnormalities associated with autism, Cell, 155(7): 1451-1463.
Huttenlocher and Dabholkar, 1997 Regional Differences in Synaptogenesis in Human Cerebral Cortex, Journal of Camparative Neurology, 387:167–178 (1997).
Jefferson 2004 Adverse events after immunisation with aluminium-containing DTP vaccines: systematic review of the evidence, The Lancet 4:84-90.
Jones et al., 2016 Autism with Intellectual Disability is Associated with Increased Levels of Maternal Cytokines and Chemokines During Gestation, Molecular Psychiatry, 22(2):273-279.
Khan et al., 2013 Slow CCL2-dependent translocation of biopersistent particles from muscle to brain, BMC Medicine, 11:99.
Kindregan et al., 2015 Gait Deviations in Children with Autism Spectrum Disorders: A Review, Autism Research and Treatment, ID:741480.
Knuesel et al., 2014, Maternal immune activation and abnormal brain development across CNS disorders, Nature Reviews 10:643-660.
Labouesse et al., 2015, Long-term pathological consequences of prenatal infection: beyond brain disorders, American Journal of Physiology, 309:1.
Li et al. 2009 Elevated Immune Response in the Brain of Autistic Patients, Journal of Neuroimmunology, 207(1-2): 111–116.
Li et al., 2015 Neonatal vaccination with bacillus Calmette–Guérin and hepatitis B vaccines modulates hippocampal synaptic plasticity in rats, Journal of Neuroimmunology, 288 (2015) 1-12.
Machado et al., 2015 Maternal Immune Activation in Nonhuman Primates Alters Social Attention in Juvenile Offspring, Biological Psychiatry, 2015 May 1;77(9):823-32.
Malkova et al., 2012 Maternal immune activation yields offspring displaying mouse versions of the three core symptoms of autism, Brain Behaviorand Immunity, 2012 May ; 26(4):607–616.
Marques et al., 2014 Autism Spectrum Disorder Secondary to Enterovirus Encephalitis, Journal of Child Neurology, 2014, Vol. 29(5) 708-714.
Mestas et al., 2004 Of Mice and Not Men: Differences between Mouse and Human Immunology, Journal of Immunology, 0022-1767:2731-2738.
Meyer et al., 2006 The Time of Prenatal Immune Challenge Determines the Specificity of Inflammation-Mediated Brain and Behavioral Pathology, The Journal of Neuroscience, 26(18):4752– 4762.
Meyer et al., 2007 The neurodevelopmental impact of prenatal infections at different times of pregnancy: the earlier the worse?, Neuroscientist, Jun;13(3):241-56.
Meyer et al., 2009 In-vivo rodent models for the experimental investigation of prenatal immune activation effects in neurodevelopmental brain disorders, Neuroscience and Biobehavioral Reviews, 33 (2009) 1061–1079.
Meyer 2014, Prenatal Poly(I:C) Exposure and Other Developmental Immune Activation Models in Rodent Systems, Biological Psychiatry, 75:307-315.
Mitkus et al., 2011 Updated aluminum pharmacokinetics following infant exposures through diet and vaccination, Vaccine 29 (2011) 9538–9543.
Offit et al., 2003 Addressing Parents’ Concerns: Do Vaccines Contain Harmful Preservatives, Adjuvants, Additives, or Residuals? Pediatrics, 112(6): 1394-1401.
Oskvig et al., 2012 Maternal immune activation by LPS selectively alters specific gene expression profiles of interneuron migration and oxidative stress in the fetus without triggering a fetal immune response, Brain Behavior and Immunity, 2012 May ; 26(4): 623–634.
Pang et al., 2016 Exploiting macrophages as targeted carrier to guide nanoparticles into glioma, Oncotarget 7(24):37081.
Parker-Athill and Tan, 2010 Maternal Immune Activation and Autism Spectrum Disorder: Interleukin-6 Signaling as a Key Mechanistic Pathway, NeuroSignals, 2010;18:113–128.
Penzes, P., et al., 2011. Dendritic spine pathology in neuropsychiatric disorders. Nat Neurosci 14, 285-293
Petrik et al., 2007 Aluminum Adjuvant Linked to Gulf War Illness Induces Motor Neuron Death in Mice, NeuroMolecular Medicine, Vol. 9, 83-100.
Pineda et al., 2013 Maternal immune activation promotes hippocampal kindling epileptogenesis in mice, Annals of Neurology, 2013 July ; 74(1): 11–19.
Podila et al., 2013 Toxicity of Engineered Nanomaterials: A Physicochemical Perspective, Journal of Biochemical and Molecular Toxicology, 2013 January ; 27(1): 50–55.
Robertson et al., 2016 Reduced GABAergic Action in the Autistic Brain, Current Biology, 26, 1-6.
Saad et al., 2016 Vitamin D status in autism spectrum disorders and the efficacy of vitamin D supplementation in autistic children, Nutritional Neuroscience, 19 (8) 346-351.
Selkoe, D. J., 2002 Alzheimer’s disease is a synaptic failure. Science 298, 789-791 (2002).
Semple et al., 2013 Brain development in rodents and humans: Identifying benchmarks of maturation and vulnerability to injury across species, Progress in Neurobiology, Jul-Aug;106-107:1-16.
Sethi et al., 2008 Aluminium-induced electrophysiological, biochemical and cognitive modifications in the hippocampus of aging rats, Neurotoxicology 29, 1069-1079.
Sethi et al., 2009 Curcumin attenuates aluminium-induced functional neurotoxicity in rats, Pharmacology, Biochemisatry, and Behavior 93:31-39.
Shen et al., 2016 Postnatal activation of TLR4 in astrocytes promotes excitatory synaptogenesis in hippocampal neurons, Journal of Cell Biology, 215(5):719-734.
Sharifi et al., 2012 Toxicity of Nanomaterials, Chemical Society Reviews, 2012 Mar 21; 41(6): 2323–2343.
Shaw and Petrik, 2009 Aluminum hydroxide injections lead to motor deficits and motor neuron degeneration, Journal of Inorganic Biochemistry 103 (11).
Shaw and Tomljenovic, 2013 Administration of aluminium to neonatal mice in vaccine relevant amounts is associated with adverse long term neurological outcomes, Journal of Inorganic Biochemistry, 128 (2013) 237–244.
Shi et al., 2009 Activation of the Maternal Immune System Alters Cerebellar Development in the Offspring, Brain, Behavior, and Immunity, January, 23(1): 116–123.
Smith et al., 2007 Maternal Immune Activation Alters Fetal Brain Development through Interleukin-6, Journal of Neuroscience, 2007 October 3; 27(40).
Smith et al., 2012, Maternal Immune Activation Increases Neonatal Mouse Cortex Thickness and Cell Density, Journal of Neuroimmune Pharmacology, 7(3):529-532.
Spires, T. L. et al., 2005 Dendritic spine abnormalities in amyloid precursor protein transgenic mice demonstrated by gene transfer and intravital multiphoton microscopy. J Neurosci 25, 7278-7287
Stiles et al., 2010 The Basics of Brain Development, Neuropsychology Reviews (2010) 20:327–348.
Suzuki et al., 2011 Plasma Cytokine Profiles in Subjects with High-Functioning Autism Spectrum Disorders, PloS ONE 6(5).
Suzuki et al., 2013 Microglial Activation in Young Adults With Autism Spectrum Disorder, JAMA Psychiatry 70(1): 49-58.
Takano 2015 Role of Microglia in Autism: Recent Advances, Developmental Neuroscience, 37:195-202.
Tau and Peterson, 2010 Normal Development of Brain Circuits, Neuropsychopharmacology, (2010) 35:147–168.
Taylor et al., 2014 Vaccines are not associated with autism: An evidence-based metaanalysis of case-control and cohort studies, Vaccine, 32:3623-3629.
Tomljenovic and Shaw, 2011 Do aluminum vaccine adjuvants contribute to the rising prevalence of autism? Journal of Inorganic Biochemistry 105.
Toro, R. et al. 2010 Key role for gene dosage and synaptic homeostasis in autism spectrum disorders. Trends Genet 26, 363-372 (2010).
Tsilioni et al., 2015 Children with autism spectrum disorders, who improved with a luteolin-containing dietary formulation, show reduced serum levels of TNF and IL-6, Translational Psychiatry, 5, 647.
Vargas et al., 2005 Neuroglial Activation and Neuroinflammation in the Brain of Patients with Autism, Annals of Neurology, 2005;57:67–81.
Viezeliene et al., 2013 Selective induction of IL-6 by aluminum-induced oxidative stress can be prevented by selenium, Journal of Trace Elements in Medicine and Biology, 27:226-229.
Wei et al., 2011 IL-6 is increased in the cerebellum of autistic brain and alters neural cell adhesion, migration and synaptic formation, Journal of Neuroinflammation 2011, 8:52.
Wei et al., 2012 (a) Brain IL-6 elevation causes neuronal circuitry imbalances and mediates autism-like behaviors, Biochimica et Biophysica Acta, 1822 (2012) 831–842.
Wei et al. 2012 (b) Alteration of brain volume in IL-6 overexpressing mice related to autism, International Journal of Developmental Neuroscience, 30:554-559.
Wei et al., 2013 Brain IL-6 and autism, Neuroscience 252 (2013): 320–325.
Wei et al., 2016 Inhibition of IL-6 trans-signaling in the brain increases sociability in the BTBR mouse model of autism, Biochimica et Biophysica Acta, 1862(10):1918-1925.
Weir et al., 2015 Preliminary evidence of neuropathology in nonhuman primates prenatally exposed to maternal immune activation, Brain, Behavior, and Immunity, 48,139–146.
Williams et al., 2006 The Profile of Memory Function in Children With Autism, Neuropsychology, 20(1): 21-29.
Wobke et al., 2014 Vitamin D in inflammatory diseases, Frontiers in Physiology, 5: 244.
Zerbo et al., 2014 Neonatal cytokines and chemokines and risk of Autism Spectrum Disorder: the Early Markers for Autism (EMA) study: a case-control study, Journal of Neuroinflammation, 11:113.
Zerbo et al., 2017 Association Between Influenza Infection and Vaccination During Pregnancy and Risk of Autism Spectrum Disorder, JAMA Pediatrics, 171(1).
SOURCE : Vaccinepapers.org


Rétroliens/Pings